广西对第二类医疗器械首次注册启用告知承诺审批
作者:云头柜 时间:2019-10-12 人气:2294次
10月12日上午广西药品监管局召开新闻发布会,为进一步提高审批服务效能,提升医疗器械产业化发展水平,让广大人民群众更快更早地享用到更多安全有效的医疗器械,广西于10月10日起在全区范围内对第二类医疗器械(包含体外诊断试剂)首次注册实行告知承诺审批。

“实行第二类医疗器械首次注册告知承诺审批,是回应产业企业对于压缩时限,简化流程相关诉求的一项举措。”广西药品监督管理局副巡视员黄琛介绍说,当前,广西正在积极推进医药医疗器械产业的发展,不少的经济开发区、产业园区在吸引区外成熟医疗器械产品落户广西时,常遇到注册检验时限较长,重复检验,过度审评等问题,给企业带来较高的时间成本,不利于企业快速进入市场。广西药监局制定第二类医疗器械首次注册告知承诺审批制度,通过将产品注册检验报告和注册质量管理体系核查后移至生产许可阶段的方式来释放政策红利,为新办企业大幅缩减产品注册时间。此举对于广西承接大湾区医疗产业战略转移、提高广西医疗器械产业发展水平和竞争力具有重要意义。
据介绍,根据中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中“加快临床急需医疗器械审评审批”的相关意见,以及《自治区党委办公厅、自治区人民政府办公厅关于印发〈广西深化审评审批制度改革鼓励药品医疗器械创新实施方案〉的通知》和《广西壮族自治区人民政府办公厅关于印发进一步推进政务服务“简易办”实施方案的通知》的相关要求,广西药品监管局深入推进第二类医疗器械首次注册审批制度改革,决定10月10日在全区范围内对第二类医疗器械(包含体外诊断试剂)首次注册实行告知承诺审批。
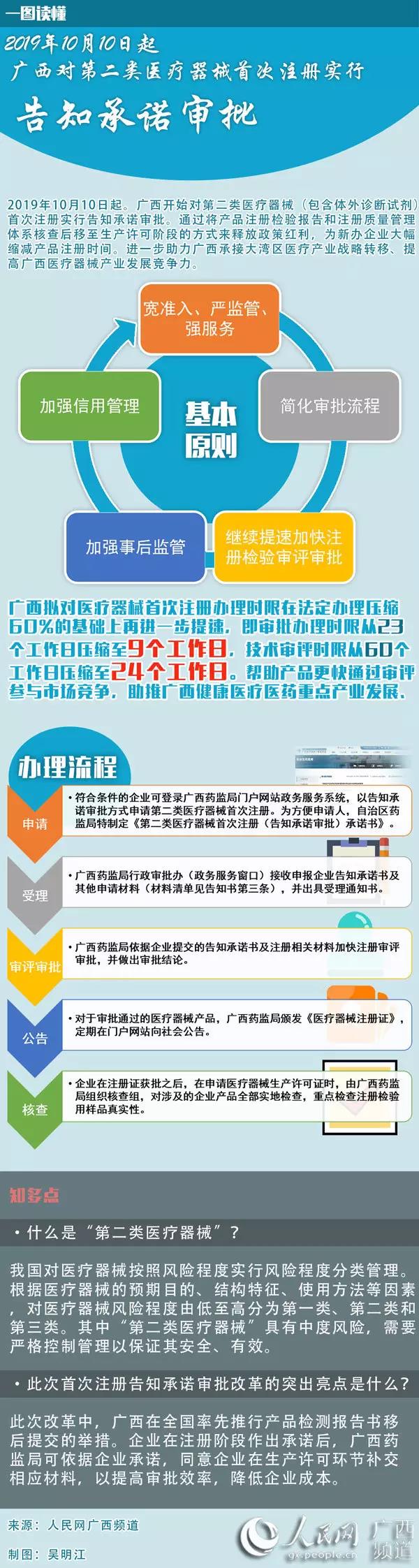
此次承诺审批改革主要遵循五个基本原则:
一是宽准入、严监管、强服务。围绕“减少审批材料、提高审批效能、服务企业发展”的总体思路,探索建立“诚信规范、审批高效、监管完善”的告知承诺审批新模式,引导第二类医疗器械产品注册管理向“宽准入、严监管、强服务”转变,推动我区医疗器械行业高质量发展。
二是简化审批流程。企业根据告知书相关内容作出符合第二类医疗器械首次注册(告知承诺审批)适用条件的承诺,自治区药监局依据企业承诺,同意企业在医疗器械生产许可环节补交相应材料,提高审批效率,提升服务效能。
三是继续提速加快注册检验审评审批。《医疗器械监督管理条例》(2017年国务院令第680号)明确规定第二类医疗器械注册审批法定时限23个工作日,技术审评法定时限60个工作日。自治区药监局拟对医疗器械首次注册办理时限在法定办理压缩60%的基础上再进一步提速,即审批办理时限压缩至9个工作日、技术审评时限压缩至24个工作日,以最快的速度、最优的质量,解决好申报企业的注册检测和技术审评时限问题。
四是加强事后监管。在企业申请医疗器械生产许可之时,行政审批机关按照法定条件和标准要求,组织对其进行合格注册检验报告及检验机构出具的产品技术要求预评价意见等材料进行技术审评,并开展注册质量管理体系及生产质量管理规范的合并现场检查。经技术审查和现场检查,发现存在实际情况与承诺内容不符的,行政审批机关将依法撤销以告知承诺审批方式获批的第二类医疗器械注册证并向社会公告,同时载入该企业的信用档案。此后,该企业不再适用于告知承诺申办方式。
五是加强信用管理。根据《广西壮族自治区食品药品安全信用分级分类管理办法(试行)》(桂食药监综〔2016〕3号)等有关规定进行信用评价,记入信用档案,进行信息共享。


